1) 철의 부식 및 영향
철은 그 자원이 풍부하며 성질도 강하고, 가공이 용이하고,가공도 싸다는 등의 이점을 갖고 있지만, 녹슬기 쉽고 그대로 두면 목재 보다 도 빨리 부식합니다. 철의 녹은 토양의 화합물로서 강도가 없어 녹으로 변하는 만큼의 철의 두께는 줄어든다.철의 두께가 1 % 녹슬면 강도는 5~10% 줄고,양면에서 두께의 5%가 녹슬면 전혀 사용할 수 없다고 한다. 또 녹은 녹을 유발하며 철면이 햇빛을 받아 간혹 빗방울이 뿌려지는 보통 상태에서 녹으로 변화하는 두께는 평균 일 년 간에 0.05~0.16mm이다. 그러나, 공기 공급이 충분하고 항상 젖어 있는 분위기에서는 1년에 1.0mm이상 소모될 때도 있다.
그리고, 철이 자연 환경에서 녹스는 데는 1) 물 2)산소라는 두 가지가 절대 필요하다. 따라서, 공기 중에서라도 습기와 물을 완전 차단 될 수 있다면 철이라도 녹슬지 않는다.
부식은 크게 나누어 건식(DRY CORROSION)과 습식(WET CORROSION)이 있으며 건식은 금속표면에 액체인 물의 작용없이 일어나는 부식이며, 일반적으로 고온산화, 고온가스에 의한 부식등이 이에 속하고, 습식은 액체인 물 또는 전해질 용액에 접하여 발생되는 부식으로 우리 주변에서 경험하는 부식의 대부분은 습식이다. 그리고 부식기구는 현재까지 물에 관여하는 부식의 대부분은 전기화학적인 기구에 의한 것으로 알려져 있다. 철의 경우 철강표면은 금속의 조성, 조직, 표면상태의 불 균일성 등으로부터 전위분포 상태가 일정하지 않고 수중에서는 국부적인 전지를 형성하게 된다. 중성수용액 중에서는 양극으로부터 철이온( Fe++ )이 용출하게 되면, 또한 음극에서는 수소이온( H+ )이 환원되어 수소원자( H )로 된다. 이 반응에 의하여 생기는 수소원자( H )는 H2가스로 되어 발산하든가 수중에 용존 되어 있는 산소와 결합하여 물( H2O )을 형성하게 된다.
국부 양극반응 Fe → Fe +2 + 2 e - ①
국부 음극반응 2H + 2 e - → 2H ②
2H +1/2O2 → H2O ③
Fe + 2H + +1/2O2 → Fe+2 +H2O ④
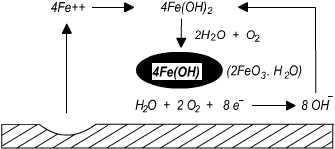
①식에서의 Fe+2는 또다시 H2O의 해리에 의한 OH-와 결합하여 수산화 제1철(황록색의 침전)이 형성되며, 이는 또한 용존 산소와 반응하여 수산화 제2 철로된다.
4Fe ++ + 8OH- --------- 4 Fe ( OH)2
4Fe(OH)2 + 2H2O + O2 --------- 4 Fe(OH)3 수산화 제2철은 분해하여 산화 제2철 수화물로 되는데 이들의 혼합물이 적청이다
4Fe(OH)3 ---------- 2Fe2O3 .H2O + 4H2O 수산화 제2철( Fe(OH)3 )또는 산화 제2철( Fe2O3 )은 적청이라고 하는데, 실제로 발생하는 녹의 조성은 생성조건에 따라 여러 가지로 복잡하다. 부식반응이 전기화학적인 것이라면 부식반응이 계속적으로 일어나기 위해서는 반응계에서 전하의 균형을 유지하지 않으면 안되기 때문에 금속 중에 전기가 남아있거나 용액 중에 이온이 남아있거나 할 수 없는 것이다. 그 이유는 ①식과 ②식은 항상 동시에 같은 양만큼 반응이 일어나게 된다. 따라서 ①식의 양극반응 ②식의 음극반응, 용액 내의 이온의 이동은 직열의 루프를 만들고 있어 이 3개중의 어느 하나만이라도 일어나지 못하게 한다면 부식반응 전체를 억제할 수 있게 된다.
방 식 방
법 |
전기화학적
인자 |
대 책 |
| 부식환경의 차단 | 양극과 음극간의 전기저항의 확대 | 1) 투과성이 적은
전색제의 선택 2) 두꺼운 도막화 3) 차단효과가 큰 안료의 배합 |
| 금속면의 부동태화 | 양극분극의 증대 | 1) 납등의 방청안료의
배합 2) 크롬 산에 의한 철 소지 부동태화 3) inhibitor의 배합 |
| 음극 방식 작용 | 음극분극의 증대 | 1) 철로부터 이온화
경향이 큰 금속 즉, 아연등을 배합한 도료 2) 아연말 화성피막 (다크로) 3) 아연도금 및 카드늄 도금 |
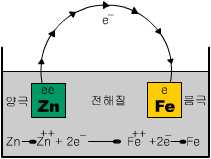
아연 또는 아연분말은 일반적으로 철보다 이온화 경향이 높아 두 금속이 전해질 속에 공존할 경우 아래의 그림과 같은 국부전지를 형성하여 전자가 아연(양극)에서 철(음극)으로 흐르게 된다. 이로써, 아연(양극)이 부식당함과 동시에 철(음극)은 보호받게 된다.